Meilensteine der Naturwissenschaft und Technik Das Atom - John Dalton und Niels Bohr
Schon in der Antike glaubten Philosophen an die Existenz kleinster Materieteilchen. Aber erst John Dalton erkannte zu Beginn des 19. Jahrhunderts, dass chemische Elemente aus gleichen Teilen, Atomen, zusammengesetzt sein müssen.
Als Form der Atome vermutete der englische Naturforscher John Dalton eine Kugelgestalt. Aus der Dicke eines Ölfilms auf einer Wasseroberfläche, der nicht beliebig dünn werden kann, ließ sich auf die Größenordnung der Atome schließen: Ihr Durchmesser musste kleiner als 1 Millionstel Millimeter sein. Für das Verhalten von Gasen bewährte sich das Kugelmodell, aber die Fragen der räumlichen Ordnung in chemischen Verbindungen, etwa in Kristallen, ließen sich damit nicht erklären.
Die Entdeckung der Elektronen
Die Atome mussten offensichtlich aus Teilchen bestehen, denn man hatte sehr kleine und leichte geladene Teilchen entdeckt, die Elektronen. Da die Atome normalerweise aber nach außen elektrisch ungeladen erscheinen, vermutete der englische Physiker John. J. Thomson, dass die Elektronen in einer positiv geladenen Atomkugel stecken. Einer seiner Schüler, der neuseeländische Forscher Ernest Rutherford, konnte aber mit seinen Versuchen nachweisen, dass Atome aus einem schweren positiven Kern und einer sehr leichten und durchlässigen Hülle aus Elektronen bestehen. Er verwendete als Messsonde die erst wenige Jahre zuvor entdeckten Alpha-Strahlen, sehr kleine, positiv geladene Teilchen, die Bestandteile der Strahlung radioaktiver Substanzen sind. Rutherford beschoss mit den Teilchen dünne Goldfolien, die aber immer noch aus einigen 100 Atomlagen bestanden. Erstaunlicherweise flogen die meisten Teilchen durch die Folie, nur wenige wurden aus ihrer Bahn abgelenkt. Rutherford schloss daraus, dass die Atome einen sehr kleinen positiven Kern besitzen, an dem die wenigen Alpha-Teilchen abgelenkt wurden. Die durchlässige Hülle sollte demnach aus den Elektronen bestehen, die den Kern umkreisen mussten, um durch die Fliehkraft die Anziehungskraft des Kerns auszugleichen. Nach diesem Modell mussten allerdings die kreisenden Elektronen Energie in Form von Wellen abstrahlen und so in kürzester Zeit in den Atomkern stürzen.
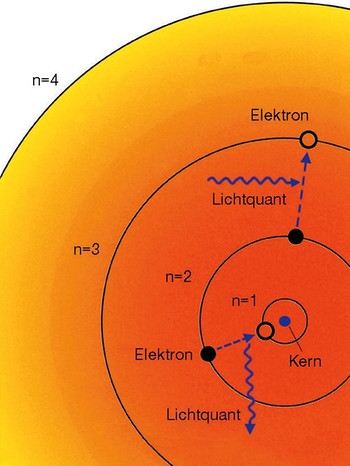
Elektronenbahnen
Ein Schüler Rutherfords, der dänische Physiker Niels Bohr , entwickelte 1913 die Theorie, dass die Elektronen sich nur auf bestimmten Bahnen aufhalten können, und dabei selbst eine stehende Welle bilden, die keine Energie abstrahlt. Der Wechsel zu einer inneren Bahn konnte dabei nur unter Energieverlust, z. B. durch Abstrahlung von Licht, der Wechsel auf eine äußere Bahn durch Energieaufnahme stattfinden, z. B. in Form von Wärme. Der Münchener Physiker Arnold Sommerfeld verbesserte das Bohrsche Atommodell weiter durch die Annahme elliptischer Elektronenbahnen. So konnte das unterschiedliche chemische Verhalten der Elemente aus der Hüllenstruktur der Atome erklärt werden.
Kernspaltung und Radioaktivität
In den folgenden Jahrzehnten untersuchten die Atomphysiker die Struktur des Kerns und entdeckten, dass er aus positiven Teilchen mit der gleichen Ladungsmenge wie die der Elektronen, aber einer rund 2.000mal so großen Masse besteht, den Protonen. Fast alle Elemente enthalten ferner im Atomkern ungeladene Teilchen mit nahezu der Masse eines Protons, die Neutronen. Mit diesen Kenntnissen konnte die Radioaktivität von Isotopen erklärt werden, aber auch die Kernumwandlung und die Kernspaltung. Resultate dieser Forschung waren die Atombombe und Atomkraftwerke. Aber auch Entwicklungen wie supraleitende Magnete für die Kernspintomographie, Laser oder die Mikrochips der Halbleiterindustrie sind ohne die Vorarbeiten der Atomphysiker nicht vorstellbar.