Metalle Physikalische und chemische Eigenschaften - Übungen
Von: Andreas Ziegler
Stand: 04.05.2017 |Bildnachweis

Unedle Metalle reagieren mit "Salzsäure" (Wasserstoffchlorid HCL(aq)). Dabei bildet sich das Gas Wasserstoff und ein Salz. Edle Metalle reagieren nicht mit Salzsäure.
Folgende Metalle werden in Salzsäure gegeben: Magnesium, Chrom und Aluminium
Formuliere für die Reaktionen jeweils eine Wort- und Formelgleichung.
Es reagieren nur die unedlen Metalle Magnesium und Aluminium.
Magnesium(s) + Wasserstoffchlorid(aq) -> Wasserstoff(g) + Magnesiumchlorid(aq)
2 Mg + 2 HCL -> H2 + 2 MgCL2
Aluminium(s) + Wasserstoffchlorid(aq) -> Wasserstoff(g) + Aluminiumchlorid(aq)
2 AL + 6 HCL -> 3 H2 + 2 ALCL3
Du bist Konstrukteur einer Automobilfirma. Du sollst Eisenfelgen vor Korrosion schützen, indem es mit einem edlen Metall überzogen werden. Dir stehen folgende Metalle zur Verfügung: Magnesium, Silber, Wolfram, Kupfer, Quecksilber
Wähle mit Hilfe folgender Tabelle begründet das Metall aus, das sich als Überzug für die Eisenfelge eignet.
| Metall | Schmelztemperatur [°C] | Preis [€/kg] | Zugabe von Salzsäure |
|---|---|---|---|
| Magnesium | 650 | 2 | Gasentwicklung |
| Silber | 962 | 550 | Keine Reaktion |
| Wolfram | 3410 | 24 | Gasentwicklung |
| Kupfer | 1085 | 5 | Keine Reaktion |
| Quecksilber | - 39 | 100 | Keine Reaktion |
Kupfer eignet sich als edles Metall sehr gut. Zudem ist es im Vergleich zu Silber günstig und hat eine hohe Schmelztemperatur.
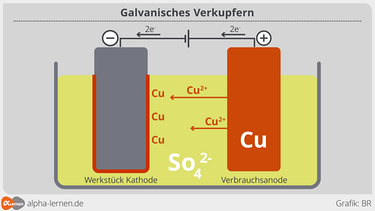
Beim so genannten Galvanisieren wird ein unedles Metall mit einem edlen Metall überzogen.
Es handelt sich dabei um ein elektrolytisches Verfahren, bei dem das unedle Metall als Kathode (Minus-Pol) geschaltet wird. Als Anode (Plus-Pol) kann das edle Metall fungieren. In der Lösung befindet sich ein Salz des edlen Metalls.
Fertige eine beschriftete Skizze des Versuchsaufbaus an.
Formuliere für die Kathodenreaktion und Anodenreaktion jeweils eine Formelgleichung.