Carbonsäuren Übungen - Eigenschaften von Carbonsäuren
Von: Christopher Müller, Isabel Puchinger, Tom Fleckenstein
Stand: 20.07.2021 |Bildnachweis

In sauren Kaugummis wird häufig Äpfelsäure verwendet. Hierbei handelt es sich um 2-Hydroxybutandisäure.
Formuliere die Reaktionsgleichung eines Äpfelsäuremoleküls mit Wasser.
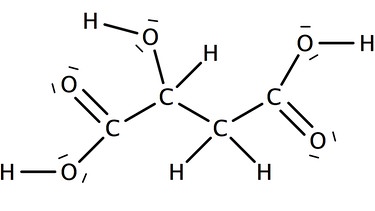
Begründe kurz auf Teilchenebene, dass die Äpfelsäure sauer reagiert.
Da die Carboxygruppe der Äpfelsäure sehr polar ist, wird leicht ein Proton abgeben. So entsteht eine saure Lösung in der Oxoniumionen vorhanden sind.
Die Polarität entsteht, da beide Sauerstoffatome im Vergleich zum Wasserstoffatom sehr elektronegativ sind und die Elektronen zu sich ziehen (orangene Pfeile). Somit wird das Proton leicht abgegeben (grüner Pfeil).
Das Abspalten eines Protons ist bei beiden Carboxygruppen möglich.
Erkläre die Beobachtung, dass Hexansäure sich nur schlecht in Wasser löst aber gut in Hexan.
Tipp: Wie immer, wenn es um Löslichkeiten geht, gilt "Ähnliches löst sich gut in Ähnlichem".
Im polaren Wasser können die polaren Carboxygruppen (blau) zwar Wasserstoffbrücken mit dem Wasser ausbilden, es überwiegt aber die Wirkung des langen hydrophoben Alkylrests (orange), so dass die Hexansäuremoleküle besser Wechselwirkung mit dem unpolaren Hexan (orange) ausbilden.
Zudem bildet Hexansäure in unpolaren Lösungsmitteln nach außen fast unpolare Dimere (siehe Zusatzwissen) und löst sich deswegen gut im unpolaren Hexan (orange).
Ordne folgende 6 Stoffe nach ihrer Säurestärke und begründe die gewählte Reihenfolge:
- 2-Propanol
- 2-Hydroxpropansäure
- 2,2,2-Trifluorethansäure
- Propansäure
- 2-Fluorethansäure
- Kaliumpropanoat
Tipp: Nach Brønsted sind Säuren Stoffe, die Protonen abgeben. Die stärkste Säure gibt Protonen am leichtesten ab, die schwächste am schwersten. Wir müssen also die Stoffe danach sortieren, wie leicht sie Protonen abgeben.
2,2,2-Trifluorethansäure ist die stärkste Säure in der Liste. Fluor ist das Element mit der höchsten Elektronegativität. Drei Fluor-Atome üben eine stark elektronenziehende Wirkung aus, wodurch die O-H-Gruppe der 2,2,2-Trifluorethansäure stark polarisiert wird, so dass das Proton leicht abgegeben werden kann.
Das einzelne Fluor-Atom der 2-Fluorethansäure übt eine weniger stark elektronenziehenden Wirkung aus.
Das Sauerstoffatom der 2-Hydroxypropansäure ist weniger elektronegativ als Fluor und die zusätzliche Methylgruppe am Kohlenstoffatom verringert die elektronenziehende Wirkung weiter.
Bei der Propansäure schließlich finden sich gar keine elektronenziehenden Gruppen mehr.
Eine deutlich schwächere Säure als die Propansäure ist das 2-Propanol, das weder eine elektronenziehende Carbonylgruppe noch eine mesomeriestabilisierte korrespondierende Base aufweist.
Die schwächste Säure ist natürlich das Propanoat-Ion, das überhaupt kein Proton mehr abzugeben hat.