Carbonsäuren Saure Zitronensäure
Von: Christopher Müller, Isabel Puchinger, Tom Fleckenstein
Stand: 20.07.2021 |Bildnachweis
Schau dir zunächst das Video auf die folgenden Fragen hin an:
- Wie entstehen die Oxoniumionen?
- Warum ist die Carboxygruppe polar?
- Wie läuft eine typische Säure-Base-Reaktion ab?
- Welcher chemische Bindungstyp liegt bei Kalk vor?
- Welcher chemische Bindungstyp liegt bei Kohlensäure vor?
Weiter unten findest du im Lerncheck die Antworten zu den Fragen und vertiefende Informationen.
Frage
Wie entstehen die Oxoniumionen?
Antwort
Die Carboxygruppe ist polar und gibt so leicht ein Proton ab. Dieses Proton ergibt mit Wasser das Oxoniumion.
Frage
Warum ist die Carboxygruppe polar?
Antwort
Die Sauerstoffatome sind stärker elektronegativ als die Wasserstoffatome und ziehen die Bindungselektronen stärker zu sich.
Frage
Wie läuft eine typische Säure-Base-Reaktion ab?
Antwort
Gemäß der Brönsted-Definition überträgt ein Protonendonator Protonen auf einen Protonenakzeptor.
Frage
Welcher chemische Bindungstyp liegt bei Kalk vor?
Antwort
Kalk ist das Salz Calciumcarbonat. Hier liegen Ionenbindungen zwischen Kationen und Anionen vor.
Frage
Welcher chemische Bindungstyp liegt bei Kohlensäure vor?
Antwort
Kohlensäure besteht aus Molekülen, in denen Atome durch Atombindungen oder auch Elektronenpaarbindungen verbunden sind.
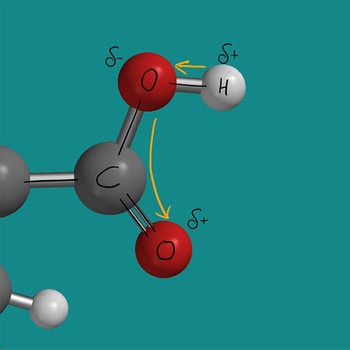
Die Carboxygruppe setzt sich aus einer Carbonylgruppe und einer Hydroxygruppe zusammen. Die Carboxygruppe und spezielle die O-H-Bindung ist stark polar und reagiert deshalb sauer. Die Polarisierung ergibt sich durch die hohe Elektronegativität der Sauerstoffatome und die geringe Elektronegativität des Wasserstoffatoms. Die Sauerstoffatome ziehen die Bindungselektronen stärker zu sich (orangene Pfeile). Zum einen zieht das Sauerstoffatom der O-H-Bindung Elektronen zu sich und zusätzlich zieht das Sauerstoffatom der C=O-Doppelbindung Elektronen zu sich.
Die starke Polarisierung der Carboxygruppe sorgt dafür, dass sich leicht das Proton (positiv geladenes Wasserstoffatom) abspaltet.
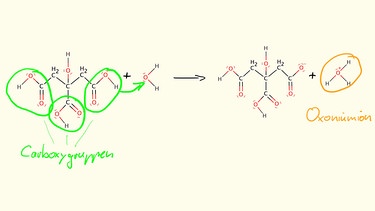
Somit reagiert ein Molekül einer beliebigen Carbonsäure als Protonendonator und damit als Säure. Das Proton wird leicht auf ein Wassermolekül übertragen, wodurch das Oxoniumion entsteht. Das Oxoniumion ist typisch für eine saure Lösung.
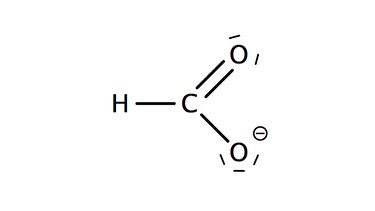
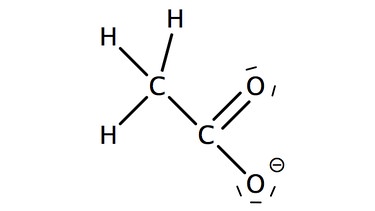
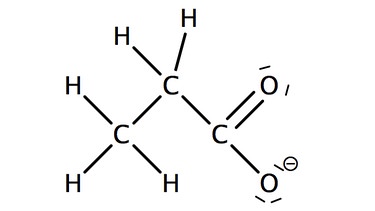
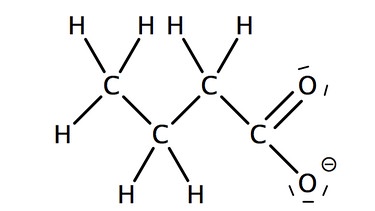
Die Salze der Alkansäuren heißen Alkanoate. Zu dem Stammnamen, der sich aus der Kettenlänge ergibt wird die Endung "oat" ergänzt. Auch für die Salze der Carbonsäuren werden häufig umgangssprachliche Trivialnamen verwendet.
Bei komplexeren Carbonsäuren werden meist nur die Trivialnamen verwendet.
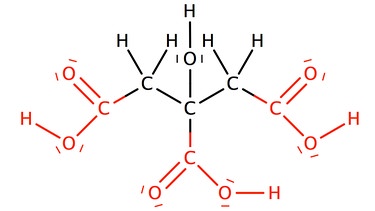
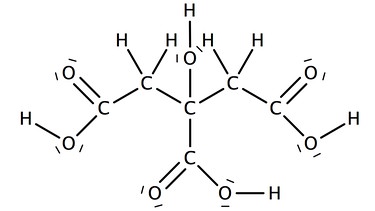
Zitronensäure
Name der Carbonsäure:
Zitronensäure
Name des Salzes:
Zitrat oder Citrat