Carbonsäuren Saure Essigsäure
Von: Christopher Müller, Isabel Puchinger, Tom Fleckenstein
Stand: 20.07.2021 |Bildnachweis
Schau dir zunächst das Video auf die folgenden Fragen hin an:
- Woraus besteht die Schale eines Eis?
- Warum reagiert die Essigsäure sauer?
- Wie lässt sich die elektrische Leitfähigkeit überprüfen?
- Was muss gegeben sein, damit eine Lösung elektrisch leitfähig ist?
Weiter unten findest du im Lerncheck die Antworten zu den Fragen und vertiefende Informationen.
Frage
Woraus besteht die Schale eines Eis?
Antwort
Die Schale besteht zu ca. 90% aus Kalk, also dem Salz Calciumcarbonat.
Frage
Warum reagiert die Essigsäure sauer?
Antwort
Wenn Essigsäure eine Proton abgibt, reagiert es als Säure und es entsteht eine saure Lösung.
Frage
Wie lässt sich die elektrische Leitfähigkeit überprüfen?
Antwort
Mit einen Messgerät lässt sich die Leitfähigkeit genau messen und mit einem Motor lässt sie sich vereinfacht bestimmen.
Frage
Was muss gegeben sein, damit eine Lösung elektrisch leitfähig ist?
Antwort
Es müssen frei bewegliche Ladungsträger vorhanden sein. In diesem Beispiel Oxoniumionen und Acetat-Anionen.
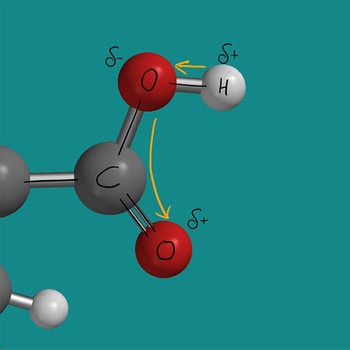
Die Carboxygruppe der Essigsäure und speziell die O-H-Bindung sind stark polar und reagieren deshalb sauer. Die Polarisierung ergibt sich durch die hohe Elektronegativität der Sauerstoffatome und die geringe Elektronegativität des Wasserstoffatoms. Die Sauerstoffatome ziehen die Bindungselektronen stärker zu sich. Zum einen zieht das Sauerstoffatom der O-H-Bindung Elektronen zu sich und zusätzlich zieht das Sauerstoffatom der C=O-Doppelbindung Elektronen zu sich.
Die starke Polarisierung der Carboxygruppe sorgt dafür, dass sich leicht das Proton (positiv geladenes Wasserstoffatom) abspaltet.
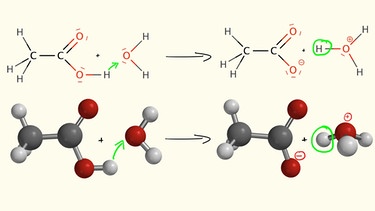
Somit reagiert ein Essigsäuremolekül als Protonendonator und damit als Säure. Das Proton wird leicht auf ein Wassermolekül übertragen wodurch das Oxoniumion entsteht und als Rest das Ethanoat oder auch Acetat-Anion. Das Oxoniumion ist typisch für eine saure Lösung und erzeugt die Verfärbung des Indikators.
Die Carboxygruppe ist auch für die Unterschiede der physikalischen Eigenschaften zwischen Ethanol und Essigsäure verantwortlich.
Elektrische Leitfähigkeit
Eine Lösung von Essigsäure in Wasser leitet den Strom deutlich stärker als eine Lösung von Ethanol. Dies ist eine direkte Folge des sauren Charakters der Essigsäure. Durch die Abgabe eines Protons an Wassermoleküle liegen in einer verdünnten Essigsäure Oxoniumionen und die Acetat-Anionen vor. Diese geladenen Teilchen leiten den elektrischen Strom.
Siedetemperatur
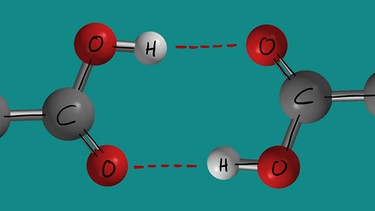
Die ungefähre Siedetemperatur von Essigsäure liegt bei 118°C, die von Propanol bei 98°C, die von Butan bei 0°C. Alle drei Moleküle haben in etwa die gleiche Molekülmasse. Während aber beim Butan nur van-der-Waals-Kräfte die Moleküle zusammenhalten, bilden sich beim Propanol und in noch stärkerem Maße bei der Essigsäure Wasserstoffbrücken aus. Tatsächlich bilden die Essigsäuremoleküle in flüssiger Essigsäure sogenannte Dimere, bei denen die Carboxygruppen zweier Essigsäuremoleküle sich Zusammenlagern und zwei Wasserstoffbrücken ausbilden.
Mischbarkeit mit Wasser
Essigsäure ist in jedem Verhältnis mit Wasser mischbar. Zwischen den Wasser- und Essigsäure-Molekülen bilden sich Wasserstoffbrücken aus. Ein kleiner Teil der Essigsäure-Moleküle gibt das Proton dabei ganz an Wasser ab (sauerer Charakter).
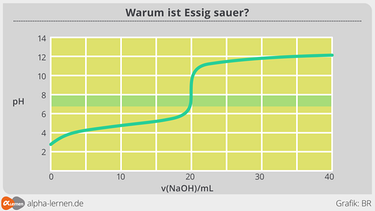
20 ml Essig werden auf 200 ml verdünnt und gut vermischt. Dem Gemisch werden 20 ml entnommen und mit 0,1 molarer Natronlauge titriert. Mit einem pH-Meter wird die Veränderung des pH-Werts verfolgt. Man erhält z. B. folgende Kurve:
Am Äquivalenzpunkt wurden 20 ml Natronlauge verbraucht, das entspricht 2 mmol. Da am Äquivalenzpunkt die gesamte Essigsäure umgesetzt wurde, muss deren Stoffmenge ebenfalls 2 mmol betragen haben. 100 ml des verdünnten Essigs enthalten also 10 mmol Essigsäure, 100 ml des unverdünnten Essigs damit 100 mmol. Die molare Masse der Essigsäure beträgt 60 g/mol. 100 mmol entprechen also 6 g Essigsäure pro 100 ml unseres Essigs. Unser Essig ist damit ein Essig, der der deutschen Essigverordnung entspricht, die festlegt: "Essig im Sinne dieser Verordnung ist das Erzeugnis, das in 100 Millilitern mindestens 5 Gramm und höchstens 15,5 Gramm Säure, berechnet als wasserfreie Essigsäure, enthält."
Interessant an der Titrationskurve ist auch der Pufferbereich auf der linken Seite. Dort ändert sich der pH-Wert trotz Zugabe der Natronlauge nur wenig. Die Wirkung der zugegebenen Natronlauge wird von der vorhandenen Essigsäure "abgepuffert". Der Essigsäure-Acetat-Puffer ist ein häufig im Labor eingesetztes Puffersystem.