Wärmelehre Die Anomalie des Wassers
Von: Christian Döllinger, Katharina Putz, Claudia Sarrazin, Rupert Ernhofer
Stand: 16.06.2021 |Bildnachweis
Schau dir zunächst das Video auf die folgenden Fragen hin an:
- Was versteht man unter Sublimation?
- Worauf ist die Sprengwirkung des Wassers beim Erstarren (Gefrieren) zurückzuführen?
- Warum schwimmen Eisberge im Wasser?
- Warum friert ein See von der Oberfläche her zu?
Weiter unten findest du die Antworten auf die Fragen und vertiefende Informationen.
Wasser hat viele ungewöhnliche Eigenschaften, von denen ihr zwei im Film kennengelernt habt: Es dehnt sich beim Erstarren, also Gefrieren, aus und es hat sein kleinstes Volumen und damit seine größte Dichte nicht bei seinem Schmelzpunkt von 0 °C, sondern bei 4 °C , also ein ganzes Stück oberhalb des Schmelzpunktes.
Davon abgesehen gibt es noch weitere von anderen Stoffen abweichende Eigenschaften: Die für uns wichtigsten sind der hohe Schmelz- und Siedepunkt des Wassers und der große Temperaturbereich, in dem Wasser im flüssigen Zustand vorliegt. Wasser hat die chemische Formel H2O, ein Wassermolekül wird also von einem Sauerstoff- und zwei Wasserstoffatomen gebildet.
Vergleicht man Wasser mit verwandten Verbindungen, die ebenfalls aus zwei Wasserstoffatomen und einem Atom aus der Sauerstoffgruppe des Periodensystems bestehen, so macht man eine überraschende Entdeckung:
| Wasser | Schwefelwasserstoff | Selenwasserstoff | Tellurwasserstoff | |
|---|---|---|---|---|
| Chem. Formel | H2O | H2S | H2Se | H2Te |
| Relative Molekülmasse | 18 | 34 | 81 | 130 |
| Schmelzpunkt °C | 0 | -85,6 | -60,4 | -51,0 |
| Siedepunkt °C | 100 | -60,8 | -41,5 | -1,8 |
| Verdampfungswärme kJ/mol | 40,6 | 18,8 | 19,3 | 23,4 |
Schaut man sich nämlich die Stoffe Schwefelwasserstoff, Selenwasserstoff und Tellurwasserstoff an, stellt man fest, dass diese bei Temperaturen schmelzen oder sieden, die umso niedriger sind, je kleiner ihre Molekülmasse ist. Bei Wasser ist das ganz anders: Als leichteste dieser Verbindungen sollte es eigentlich die niedrigsten Schmelz- und Siedepunkte haben. Das Schmelzen sollte also bei einer Temperatur unterhalb von -85,6°C erfolgen, das Sieden unterhalb von -60,8°C – ein krasser Widerspruch zu den tatsächlichen Werten, die weit höher liegen. Außerdem ist der Bereich, in dem Wasser flüssig ist, viel umfassender als bei den verwandten Verbindungen. Ohne diese anomalen Eigenschaften des Wassers gäbe es kein Leben auf der Erde und wir könnten uns nicht den Kopf zerbrechen, warum dies so ist!
Wasser besitzt eine besonders hohe Verdampfungswärme, d. h. wer 1 Mol Wasser (das sind 18g) bei konstanter Temperatur durch Sieden verdampfen will, muss mehr als doppelt so viel Wärme zuführen wie bei den anderen oben genannten Verbindungen – und das, obwohl diese eine größere Molekülmasse haben.
Die Einheit "Mol" eignet sich besonders gut zum Vergleich von Stoffeigenschaften, da in einem Mol eines jeden Stoffes - also der Menge, deren Masse in Gramm ihrer relativen Molekülmasse entspricht - dieselbe Anzahl von Teilchen enthalten ist, nämlich 6,023 · 1023. 1 Mol eines jeden Stoffes enthält diese unglaublich große Zahl an Molekülen.
Beim Siedepunkt einer Flüssigkeit ist die (mittlere) Bewegungsenergie ihrer Moleküle so groß geworden, dass die zwischen den Molekülen wirkenden Kräfte nicht mehr in der Lage sind, diese Moleküle zusammenzuhalten. Immer mehr Teilchen können aufgrund dieser großen Bewegungsenergie aus der Flüssigkeit austreten, wobei sich auch im Inneren der Flüssigkeit Dampfblasen bilden, in denen sich die Moleküle von den Kräften weitgehend befreit haben.
Zuerst verlassen die Moleküle mit besonders hoher Bewegungsenergie die Flüssigkeit. Durch die zum Aufrechterhalten des Siedevorgangs erforderliche Wärmezufuhr erreichen nach und nach alle in der Flüssigkeit zunächst zurückgebliebenen Moleküle die erforderliche Bewegungsenergie zum Verlassen der Flüssigkeit. Schließlich ist die gesamte Flüssigkeit verdampft.
Die Wärme, die man einer Flüssigkeit nach dem Erreichen des Siedepunktes zuführen muss, um sie vollständig zu verdampfen, nennt man – bezogen auf 1 kg – ihre spezifische Verdampfungswärme. Sie bewirkt ausschließlich den Übergang vom flüssigen in den gasförmigen Zustand, ohne dass sich dabei die Temperatur erhöht. Beim Wasser zum Beispiel entsteht so bei der Siedetemperatur von 100°C Wasserdampf derselben Temperatur. Gleichzeitig vergrößert sich das Volumen enorm: Aus 1 l Wasser werden bei Normaldruck 1.667 l Wasserdampf. Das ist eine Volumenausdehnung um mehr als das 1.000-fache und funktioniert übrigens nur, weil für so eine enorme Ausdehnung ein Teil der zugeführten Verdampfungswärme benötigt wird, um gewissermaßen die Luft "wegzuschieben", und zwar gegen die Wirkung des äußeren Drucks (i. a. des Luftdrucks).
Nicht zuletzt deshalb ist die spezifische Verdampfungswärme von Wasser etwa siebenmal größer als seine spezifische Schmelzwärme.
Ganz ähnlich läuft der Schmelzvorgang ab: Die Bewegungsenergie der in der Gitterstruktur des festen Zustandes gefangenen Teilchen ist mit dem Erreichen des Schmelzpunktes so groß geworden, dass die Teilchen ihre Gitterplätze verlassen können und die geordnete Gitterstruktur weitgehend aufgelöst wird.
Je größer die Kräfte zwischen den Molekülen sind, desto stärker ist ihr Zusammenhalt. Um diesen Zusammenhalt zu überwinden, muss ihre mittlere Bewegungsenergie größer werden. Dabei gilt: Je größer die zwischen den Molekülen wirkenden Kräfte sind, desto mehr Wärme erfordert das Sieden, d. h. je größer dieTeilchenkräfte, desto größer ist die (spezifische) Verdampfungswärme der betreffenden Flüssigkeit und desto höher liegt der Siedepunkt der Flüssigkeit.
Im folgenden erfährst du, was Wasserstoffbrückenbindungen sind und welche Konsequenzen für die Eigenschaften von Wasser sich daraus ergeben.
Dass Wasser einen höheren Siedepunkt hat als vergleichbare Wasserstoffverbindungen liegt daran, dass die Kräfte zwischen seinen Molekülen größer sind als die Kräfte zwischen den Molekülen anderer Wasserstoffverbindungen.
Versuch
Ein kleiner Versuch, den ihr leicht zu Hause durchführen könnt, hilft uns bei der Erklärung ein Stück weiter: Nehmt einen Kunststoffstab, etwa einen Kochlöffel aus Kunststoff und reibt ihn z. B. mit einem Seidentuch. Dadurch wird der Stab elektrisch aufgeladen. Dreht dann einen Wasserhahn leicht auf, so dass ein dünner Wasserstrahl aus dem Hahn ausläuft. Nähert dem Wasserstrahl den elektrisch geladenen Kunsststoffstab – wie durch Zauberkräfte krümmt sich der Wasserstrahl zum Stab hin.
Das lässt nur den Schluss zu, dass die Wassermoleküle vom elektrisch geladenen Kunststoffstab angezogen werden – aber warum? Die Moleküle sind doch elektrisch neutral?
Ein Wassermolekül hat eine gewinkelte Struktur (siehe Grafik) und ist aus zwei sehr ungleichen Partnern zusammengesetzt, nämlich aus zwei Wasserstoffatomen und einem Sauerstoffatom. Abgesehen von ihrer Größe unterscheiden sich Wasserstoffatome und Sauerstoffatom vor allem in ihrer sogenannten Elektro-Negativität: Im Wassermolekül ist jedes Wasserstoffatom mit dem Sauerstoffatom kovalent gebunden, d. h. sie teilen sich jeweils ein gemeinsames Elektronenpaar.
Das Sauerstoffatom hat – unter anderem wegen der größeren positiven Kernladung – eine größere Elektro-Negativität. Deshalb zieht es die beiden gemeinsamen Elektronenpaare, die es sich mit den beiden Wasserstoffatomen teilt, nahe zu sich heran. Wasserstoffatome und Sauerstoffatom sind also keine gleichberechtigten Teilhaber an den gemeinsamen Elektronenpaaren.
In obiger Skizze sieht man: Der Bindungswinkel beim Wassermolekül beträgt 104,5°. Wäre der Bindungswinkel 180°, so wäre die Ladungsverteilung symmetrisch und hätte keine Auswirkungen auf die elektrischen Eigenschaften des Moleküls. Diese Abweichung kommt folgendermaßen zustande: Das Sauerstoffatom besitzt 6 Elektronen, von denen nur 2 für die Bildung der Elektronenpaare mit den beiden Wasserstoffatomen benötigt werden, die restlichen 4 Elektronen bilden zwei freie Elektronenpaare. Und die Kraftwirkung, die von den beiden freien Elektronenpaaren auf die zwei bindenden Elektronenpaare ausgeübt wird, ist für den Knickwinkel verantwortlich.
Dies hat zur Folge, dass die Ladungsschwerpunkte im Wassermolekül nicht mehr zusammenfallen: Insgesamt bleibt es zwar elektrisch neutral, aber es hat ein positives Ende, das bei den beiden Wasserstoffatomen liegt, und ein negatives Ende, das beim Sauerstoffatom liegt. Das Wassermolekül stellt also einen Dipol dar, vergleichbar einem Stabmagneten.
Und damit können wir auch das Verhalten des Wasserstrahls, dem wir einen geladenen Kunststoffstab nähern, erklären. Durch das Reiben mit dem Seidentuch wird der Stab negativ aufgeladen: Da die Wassermoleküle permanente Dipole darstellen, richten sie sich im elektrischen Feld des geladenen Kunststoffstabes so aus, dass das positive Ende der Wassermoleküle dem negativ geladenen Kunststoffstab zugewandt ist. Da sich ungleichnamige Ladungen anziehen, wird der Wasserstrahl zum Stab hin gebogen.
Diese Polarität der Wassermoleküle hat eine einschneidende Konsequenz: Jedes Wasserstoffatom eines Wassermoleküls wirkt infolge der Verschiebung des gemeinsamen Elektronenpaares zum Sauerstoffatom hin wie eine positive Ladung und zieht daher ein Sauerstoffatom, also den negativen Pol eines benachbarten Wassermoleküls an. Es stellt damit gewissermaßen eine Brücke dar, durch die zwei Wassermoleküle miteinander verbunden sind. Man bezeichnet daher diese Art der Bindung zwischen zwei Wassermolekülen als "Wasserstoffbrückenbindung".
Die damit verbundenen Bindungskräfte zwischen zwei Wassermolekülen sind zwar viel schwächer als die Elektronenpaarbindung zwischen den Atomen des Wassermoleküls, aber weitaus stärker als die sogenannten van der Waals-Kräfte, die bei den Stoffen, deren Moleküle keinen Dipolcharakter haben, für den Zusammenhalt der Moleküle sorgen. Diese von den Wasserstoffbrückenbindungen vermittelten großen Kräfte zwischen den Wassermolekülen sind der Grund für den hohen Schmelz- und Siedepunkt sowie die große Verdampfungswärme des Wassers.
Wasserstoffbrückenbindungen können sich nur bei Molekülen ausbilden, in denen Wasserstoff mit stark elektro-negativen Atomen verbunden ist. Dazu gehört neben Sauerstoff beim Wasser noch Fluor beim Fluorwasserstoff (auch als Flusssäure bezeichnet) und – in etwas weniger stark ausgeprägtem Maße – Stickstoff beim Ammoniak. Alle diese Stoffe zeichnen sich durch besonders hohe Schmelz- und Siedepunkte im Vergleich zu verwandten Verbindungen aus.
Die Wasserstoffbrückenbindung zwischen den Wassermolekülen ist nicht nur für den hohen Schmelz- bzw. Siedepunkt von Wasser verantwortlich, sondern auch für die sogenannte Anomalie des Wassers. Dies ist für die Natur im Winter ein folgenreiches Phänomen: Wasser hat seine größte Dichte nicht an seinem Schmelzpunkt von 0°C, sondern erst bei 4°C. Auch die Ausdehnung von Wasser beim Erstarren, also Gefrieren, ist eine Folge seiner Wasserstoffbrückenbindungen.
Wie lässt sich das erklären? Ein Wassermolkül hat wegen der beiden freien, also für die Bindung mit den Wasserstoffatomen nicht benötigten Elektronenpaaren eine räumliche Struktur: Die vier für die kovalente Bindung des Sauerstoffatoms mit den beiden Wasserstoffatomen nicht benötigten Elektronen des Sauerstoffatoms schließen sich zu zwei Paaren zusammen und bilden jeweils ein freies (also bindungsloses) Elektronenpaar. Wegen den zwischen ihnen wirkenden abstoßenden Kräften ordnen sie sich so an, dass sie innerhalb des Moleküls den größtmöglichen Abstand zueinander und von den beiden Wasserstoffatomen im Wassermolekül einnehmen. Sie bilden einen Tetraeder, also eine Pyramide mit vier gleichseitigen Dreiecken als Seitenflächen bzw. Grundfläche.
Im Zentrum des Tetraeders sitzt das Sauerstoffatom, zwei Ecken werden durch die Wasserstoffatome und die restlichen beiden durch die zwei freien Elektronenpaare gebildet. Diese beiden freien Elektronenpaare stellen gewissermaßen Haken dar. An diesen Haken kann jeweils ein Wasserstoffatom eines benachbarten Wassermoleküls andocken, das durch die Verschiebung des gemeinsamen Bindungselektronenpaares zum Sauerstoffatom hin wie eine positive (Teil-) Ladung wirkt. Dadurch entstehen zwei weitere Wasserstoffbrücken mit den freien Elektronenpaaren als Brückenköpfe, an die jeweils zwei benachbarte Wassermoleküle über deren Wasserstoffatome angekoppelt werden können.
Jedes Wasseratom kann demnach mit bis zu vier benachbarten Wassermolekülen Wasserstoffbrücken bilden: je zwei über seine beiden Wasserstoffatome und seine beiden freien Elektronenpaare.
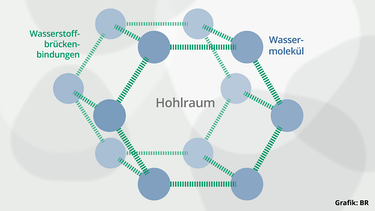
Beim Eis, also Wasser im festen Zustand, sind alle vier Wasserstoffbrücken pro Wassermolekül ausgebildet, jedes Wassermolekül ist also in einer solchen Wasserstoffbrücke gefangen. Die Folge: Die Wassermoleküle sind vernetzt. Sie bilden hexagonale, also sechseckige Strukturen (sogenannte "Cluster"), die einen großen Hohlraum umschließen.
Ist der Schmelzpunkt erreicht, werden nach und nach zwei der vier Wasserstoffbrücken aufgebrochen. Die Wassermoleküle sind also nicht mehr in ein und derselben Brückenbindung eingeschlossen, sondern können diese verlassen und eine andere vorübergehend schließen – ein Kommen und Gehen der Wassermoleküle. Obwohl die Wassermoleküle beweglich werden, bleibt der von den Wasserstoffbrückenbindungen erzwungene Ordnungszustand mit wechselnden Partnern in einem dynamischen Prozess weitgehend erhalten. Innerhalb von Billionstel Sekunden kommt es zu einem ständigen Wechsel von Aufbrechen und Neubildung des Clustersystems. Die betroffenen, kurzfristig freigesetzten Wassermoleküle können dadurch teilweise die Hohlräume der sechseckigen Strukturen ausfüllen, was nichts anderes heißt, als dass das Volumen von Eis beim Schmelzen kleiner wird.
Dieses Ausfüllen der sechseckigen Cluster-Hohlräume setzt mit dem Beginn des Schmelzens ein und setzt sich zunächst fort; deshalb verringert sich das Volumen bis 4°C weiter, erst dann überwiegt aufgrund der heftigeren Bewegung der Wassermoleküle die Ausdehnung.
- Große Bedeutung für die Natur hat die Kapillarwirkung des Wassers: etwa wenn das Wasser aus dem Boden in den feinen Kapillaren der Baumstämme bis in die Baumwipfel aufsteigen und somit den ganzen Baum mit Wasser versorgen kann. Grund für diese Kapillarwirkung sind die großen Kräften zwischen den Wassermolekülen infolge der Wasserstoffbrückenbindung. Sie führen dazu, dass das Wasser Oberflächen fester Körper, mit denen es in Berührung kommt, benetzt: Taucht man ein enges Glasrohr (eine Kapillare) in ein Wasserglas, so steigt das Wasser in der Kapillare umso höher, je kleiner deren Querschnitt ist.
- Wasser empfinden wir außerdem als nass, weil Wasser die Haut benetzt. Dazu kommt die Kühlwirkung durch die Verdunstung des Wassers auf unserer Haut.
- Wasser ist zudem ein wichtiges Lösungsmittel für Stoffe, deren Moleküle ebenfalls Dipolcharakter haben, wie z. B. Salze (die Salzmoleküle bilden aufgrund der Ionenbindung besonders starke Dipole) und Alkohole. Stoffe, deren Moleküle nicht polar sind wie etwa Öl, lösen sich im Wasser dagegen nicht.
- Wasser erscheint uns blau, weil es rotes Licht weitgehend absorbiert und im reflektierten Licht der Blauanteil demzufolge überwiegt.
Normalerweise gefriert Wasser bei 0°C. Gibt man Salz hinzu, bleibt es allerdings auch bei weitaus tieferen Temperaturen flüssig. Das Salz in dieser "Kältemischung" bewirkt, dass der Eispunkt von Wasser deutlich herabgesetzt wird. Die sogenannte Kältemischung hat bei einer Temperatur von ca. -16 °C noch die Eigenschaften einer Flüssigkeit. Diese Mischung ist "weich", aber nicht fest. In den Polregionen ist es allerdings so kalt, dass auch dieser Effekt nichts mehr bringt und das Salzwasser der Meere gefriert.
Um dem Kältetod vorzubeugen, haben Pflanzen einige raffinierte Strategien entwickelt. Die meisten Bäume und Sträucher werfen einfach ihre Blätter ab, bevor sie einfrieren können.
Eine andere Lösung haben die immergrünen Pflanzen gefunden. Sie bringen eine Zuckerlösung in ihre Blätter ein, die genauso wirkt wie das Salz in der Kältemischung: Weil der Zucker den Eispunkt senkt, halten die Blätter den Minusgraden unbeschadet Stand.
Frage
Was versteht man unter Sublimation?
Antwort
Unter Sublimation versteht man den direkten Übergang vom festen in den gasförmigen Zustand.
Frage
Worauf ist die Sprengwirkung des Wassers beim Erstarren (Gefrieren) zurückzuführen?
Antwort
Wasser dehnt sich im Gegensatz zu anderen Flüssigkeiten beim Erstarren aus. Die dabei auftretenden Kräfte sind enorm und sorgen unter anderem für das Platzen von Wasserleitungen, Frostaufbrüche bei Straßen und Verwitterung im Gebirge.
Frage
Warum schwimmen Eisberge im Wasser?
Antwort
Wegen der Volumenvergrößerung beim Erstarren ist die Dichte von Eis kleiner als die von flüssigem Wasser, daher schwimmt Eis auf dem Wasser.
Frage
Warum friert ein See von der Oberfläche her zu?
Antwort
Wasser hat bei 4°C seine größte Dichte. Hat sich die oberste Schicht auf 4°C abgekühlt, kann sie nicht mehr nach unten sinken, da die Temperatur der darunter liegenden Schichten ebenfalls 4°C beträgt. Das Gewässer hat dann eine einheitliche Temperatur von 4°C. Bei weiterer Abkühlung auf 3°C herunter bis 0°C kann die oberste Schicht jeweils nicht mehr absinken, da ihre Dichte stets kleiner ist als die der darunter liegenden "wärmeren" Schicht.