Wärmelehre Übungen zur Temperaturmessung
Von: Christian Döllinger
Stand: 16.06.2021 |Bildnachweis

Nimm zur folgenden Aussage Stellung:
Die Wahl des Schmelzpunktes von Eis und des Siedepunktes von Wasser durch Anders Celsius als Fixpunkte seiner Temperaturskala war eine glückliche Eingebung, andererseits bringt sie aber auch Probleme mit sich.
Während des Schmelzens und während des Siedens bleibt die Temperatur trotz Wärmezufuhr unverändert, so dass man diese beiden Fixpunkte leicht reproduzieren kann. Andererseits hängen der Schmelzpunkt von Eis und vor allem der Siedepunkt von Wasser von äußeren Einflüssen wie dem Druck ab (in der Höhe siedet Wasser aufgrund des dort herrschenden niedrigeren Drucks schon bei einer tieferen Temperatur). Diese Abhängigkeiten erschweren das Eichen eines Thermometers.
Welche Nachteile weisen Flüssigkeitsthermometer wie das Quecksiberthermometer gegenüber elektronischen Temperaturmessgeräten auf?
- Die Celsius-Temperaturskala weist eine lineare Einteilung auf, das heißt die Markierungsstriche haben jeweils denselben Abstand. Eine derartige äquidistante Einteilung ist aber nur dann gerechtferigt, wenn die Volumenausdehnung der Flüssigkeit gleichmäßig erfolgt, sprich: wenn ihre Volumenausdehnungszahl exakt konstant ist. Dies trifft aber nicht zu: Die Volumenausdehnungszahl ändert sich – wenn auch nur geringfügig – innerhalb eines größeren Temperaturintervalls, etwa von 0 °C bis 100 °C. Am Besten erfüllt noch Quecksilber die Bedingung einer konstanten Volumenausdehnungszahl.
- Die Thermometerflüssigkeit ist in der Regel von Glas umschlossen. Das erhöht die Bruchgefahr. Insbesondere bei einem Quecksilberthermometer kann ein Auslaufen fatale Folgen haben. Quecksilberdämpfe sind nämlich hochgiftig. Außerdem führt die schlechte Wärmeleitfähigkeit von Glas dazu, dass die Thermometerflüssigkeit verzögert die Temperatur des Meßobjekts annimmt.
- Vor allem größere Flüssigkeitsthermometer haben eine große Wärmekapazität. Will man damit zum Beispiel die Temperatur einer kleinen Flüssigkeitsmenge mit niedriger Temperatur messen, so wird die Messung verfälscht. Das Thermometer gibt nämlich Wärme an die Flüssigkeit ab und zeigt dadurch eine zu hohe Temperatur an.
Warum eignet sich Wasser nicht als Thermometerflüssigkeit?
Dafür sind zwei Gründe ausschlaggebend:
- Ein Flüssigkeitsthermometer kann nur in dem Temperaturbereich eingesetzt werden, in dem die Thermometerflüssigkeit im flüssigen Zustand vorkommt. Dieser Bereich ist bei Wasser im Gegensatz zu Alkohol relativ klein.
- Wasser zeigt ein sehr ungewöhnliches ("anomales") Ausdehnungsverhalten bei Temperaturänderungen im Bereich von 0 bis ca. 10 °C: Während sich nahezu alle anderen Flüssigkeiten vom Schmelzpunkt an kontinuierlich ausdehnen, zieht sich das Wasser von 0 °C bis 4 °C zusammen und dehnt sich erst dann aus. Daher wären die Anzeigen im unteren Temperaturbereich bis etwa 10 °C nicht eindeutig, sondern müssten jeweils zwei Temperaturwerten zugeordnet werden.
Abgesehen von diesen grundsätzlichen Problemen schwankt die Volumenausdehnungszahl von Wasser im Temperaturbereich zwischen 0 °C und 100 °C relativ stark.
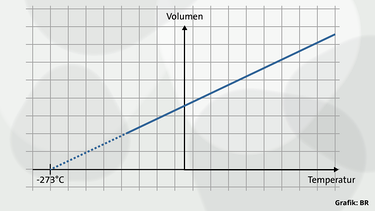
Die Existenz eines absoluten Nullpunktes der Temperatur wird in der Schule oft damit begründet, dass das Volumen eines idealen Gases beim absoluten Nullpunkt – aufgrund der für alle idealen Gase gültigen Volumenausdehnungszahl von 1/273 °C – verschwindet und es natürlich keine negativen Volumenwerte geben kann.
Der Wert 1/273 °C der Volumenausdehnungszahl bedeutet für einen Abkühlungsvorgang, dass sich das Volumen eines idealen Gases bei einer Abkühlung um 1 °C um 1/273-tel seines Volumens bei 0 °C verringert. Demnach müsste das Gasvolumen bei -273 °C völlig verschwinden. Es bleibt dann nur noch das Eigenvolumen der Gasmoleküle übrig. Nimm Stellung zu dieser Argumentation.
Die Schlussfolgerung führt tatsächlich zum richtigen Ergebnis für den absoluten Nullpunkt (das liegt an der für alle idealen Gase gültigen Volumenausdehnungszahl von 1/273 °C). Die Begründung ist aber nicht ganz korrekt:
Ideales Gas
Unter einem idealen Gas versteht man ein Gas, bei dem die Gasmoleküle – außer bei Zusammenstößen – keine Kräfte aufeinander ausüben und bei dem das Eigenvolumen der Gasmoleküle gegenüber dem gesamten Gasvolumen vernachlässigbar klein ist. Gase, deren Temperatur weit über ihrem Siedepunkt liegt und die unter keinem zu hohen Druck stehen, erfüllen weitgehend die Bedingungen für ein ideales Gas, so zum Beispiel die permanenten Gase Helium, Wasserstoff, Stickstoff und Sauerstoff bei Zimmertemperatur. Für alle diese Gase gilt in dem Bereich, in dem man sie noch als ideales Gas ansehen kann, dieselbe Volumenausdehnungszahl von 1/273 °C.
- Wird ein Gas, das sich bei Ausgangstemperatur wie ein ideales Gas verhält, abgekühlt, so verringert sich die (mittlere) Bewegungsenergie seiner Moleküle. Sie bleiben dadurch länger im Einwirkungsbereich benachbarter Moleküle. Zudem wird der Raum, in dem sie sich bewegen können, durch die Volumenabnahme kleiner: Sie werden also enger zusammengedrängt. Aufgrund der Verringerung des mittleren Abstandes der Gasmoleküle und ihrer mit der Abkühlung langsamer werdenden Bewegung machen sich von einer bestimmten Temperatur an die Kräfte zwischen den Gasmolekülen bemerkbar. Zudem verringert sich das Gasvolumen, während das Eigenvolumen der Gasmoleküle gleich bleibt. Das Gas verhält sich dann nicht mehr wie ein ideales Gas: Seine Volumenausdehnungszahl weicht von dem für ideale Gase ab und stimmt außerdem nicht mehr für alle Gase überein.
- Bei sehr tiefen Temperaturen werden alle Gase flüssig, ab diesem Punkt gibt es besonders starke Abweichungen von der Volumenausdehnungszahl idealer Gase, Flüssigkeiten ziehen sich bei Abkühlung weit weniger stark zusammen.
Es ist erstaunlich, dass trotz der nicht stichhaltigen Argumentation mit der Volumenausdehnungszahl idealer Gase die Schlussfolgerung bezüglich des absoluten Nullpunktes zutrifft.